Boltzmanns st?ndiga definition. Boltzmann konstant
Boltzmann konstant ( eller ) - en fysisk konstant som definierar f?rh?llandet mellan temperatur och energi. Uppkallad efter den ?sterrikiske fysikern Ludwig Boltzmann, som gjorde stora bidrag till statistisk fysik, d?r denna konstant spelar en nyckelroll. Dess experimentella v?rde i International System of Units (SI) ?r:
J/.
Siffrorna inom parentes anger standardfelet i de sista siffrorna i kvantitetsv?rdet. I det naturliga systemet av Planck-enheter ges den naturliga temperaturenheten s? att Boltzmanns konstant ?r lika med enhet.
Samband mellan temperatur och energi
I en homogen idealgas vid absolut temperatur , energin per varje translationell frihetsgrad ?r lika, enligt Maxwell-f?rdelningen, . Vid rumstemperatur (300 °C) ?r denna energi J eller 0,013 eV. I en monoatomisk idealgas har varje atom tre frihetsgrader motsvarande tre rumsliga axlar, vilket inneb?r att varje atom har en energi p? .
Genom att k?nna till den termiska energin kan vi ber?kna atomernas rotmedelkvadrathastighet, som ?r omv?nt proportionell mot kvadratroten av atommassan. Medelkvadrathastigheten vid rumstemperatur varierar fr?n 1370 m/s f?r helium till 240 m/s f?r xenon. N?r det g?ller en molekyl?r gas blir situationen mer komplicerad, till exempel har en diatomisk gas fem frihetsgrader (vid l?ga temperaturer, n?r vibrationer av atomer i molekylen inte exciteras).
Definition av entropi
Entropin i ett termodynamiskt system definieras som den naturliga logaritmen f?r antalet olika mikrotillst?nd , motsvarande ett givet makroskopiskt tillst?nd (till exempel ett tillst?nd med en given total energi).
Proportionalitetsfaktor och ?r Boltzmanns konstant. Detta ?r ett uttryck som definierar f?rh?llandet mellan mikroskopiska ( ) och makroskopiska tillst?nd ( ), uttrycker den centrala id?n om statistisk mekanik.
Antagen v?rdefixering
Den XXIV allm?nna konferensen om vikter och m?tt, som h?lls den 17-21 oktober 2011, antog en resolution d?r det framf?r allt f?reslogs att den framtida revideringen av det internationella enhetssystemet skulle genomf?ras p? ett s?dant s?tt att fixera v?rdet p? Boltzmann-konstanten, varefter det kommer att anses vara definitivt exakt. Som ett resultat kommer det att utf?ras exakt j?mlikhet k=1,380 6X 10 -23 J/K. Denna p?st?dda fixering ?r f?rknippad med ?nskan att omdefiniera enheten f?r termodynamisk temperatur kelvin, vilket f?rbinder dess v?rde med v?rdet p? Boltzmanns konstant.
se ?ven
Skriv en recension om artikeln "Boltzmanns konstant"
Anteckningar
| Detta ?r ett utkast till artikel om termodynamik och statistisk fysik. Du kan hj?lpa projektet genom att l?gga till det. |
Ett utdrag som karakt?riserar Boltzmanns konstant
– Men vad betyder detta? – sa Natasha eftert?nksamt.- ?h, jag vet inte hur extraordin?rt allt det h?r ?r! - sa Sonya och h?ll om huvudet.
N?gra minuter senare ringde prins Andrei och Natasha kom in f?r att tr?ffa honom; och Sonya, som upplevde en k?nsla och ?mhet som hon s?llan hade upplevt, stannade kvar vid f?nstret och begrundade det extraordin?ra i det som hade h?nt.
Den h?r dagen fanns det m?jlighet att skicka brev till arm?n, och grevinnan skrev ett brev till sin son.
"Sonya," sa grevinnan och lyfte huvudet fr?n brevet n?r hennes systerdotter gick f?rbi henne. – Sonya, vill du inte skriva till Nikolenka? - sa grevinnan med tyst, darrande r?st, och i blicken av sina tr?tta ?gon, tittade genom glas?gon, l?ste Sonya allt som grevinnan f?rstod i dessa ord. Denna blick uttryckte v?djande, r?dsla f?r v?gran, skam ?ver att beh?va fr?ga och beredskap f?r of?rsonligt hat i h?ndelse av avslag.
Sonya gick fram till grevinnan och kn?b?jde och kysste hennes hand.
"Jag ska skriva, mamma", sa hon.
Sonya blev uppmjukad, upprymd och ber?rd av allt som h?nde den dagen, s?rskilt av det mystiska framtr?dandet av sp?dom som hon just s?g. Nu n?r hon visste att Nikolai inte kunde gifta sig med prinsessan Marya i samband med f?rnyelsen av Natashas f?rh?llande till prins Andrei, k?nde hon med gl?dje ?terkomsten av den sj?lvuppoffrande st?mningen d?r hon ?lskade och var van att leva. Och med t?rar i ?gonen och med gl?djen att f?rverkliga en gener?s g?rning, skrev hon, flera g?nger avbruten av t?rar som grumlade hennes sammetslena svarta ?gon, det d?r r?rande brevet, vars mottagande f?rv?nade Nikolai s?.
Vid vakthuset dit Pierre f?rdes behandlade officeren och soldaterna som tog honom honom med fientlighet, men samtidigt med respekt. Man kunde fortfarande i deras inst?llning till honom k?nna tvivel om vem han var (om han var en mycket viktig person), och fientlighet p? grund av deras fortfarande f?rska personliga kamp med honom.
Men n?r skiftet p? morgonen en annan dag kom k?nde Pierre att det f?r den nya gardet – f?r officerarna och soldaterna – inte l?ngre hade den betydelse som det hade f?r dem som tog honom. Och faktiskt, i den h?r stora, tjocka mannen i en bondkaftan s?g inte l?ngre vakterna den d?r levande mannen som s? desperat slogs med marod?ren och med eskortsoldaterna och sa en h?gtidlig fras om att r?dda barnet, utan s?g endast den sjuttonde av dem som av n?gon anledning, p? order av de h?gsta myndigheterna, h?lls f?ngslade, de tillf?ngatagna ryssarna. Om det var n?got speciellt med Pierre s? var det bara hans blyga, intensivt eftert?nksamma utseende och det franska spr?ket, som han, ?verraskande nog f?r fransm?nnen, talade bra. Trots det faktum att Pierre samma dag var kopplad till andra misst?nkta misst?nkta, eftersom det separata rummet han ockuperade beh?vdes av en officer.
Alla de ryssar som h?lls med Pierre var m?nniskor av den l?gsta rangen. Och alla av dem, som k?nde igen Pierre som en m?stare, undvek honom, s?rskilt eftersom han talade franska. Pierre h?rde med sorg f?rl?jligandet av sig sj?lv.
N?sta kv?ll fick Pierre veta att alla dessa f?ngar (och f?rmodligen han sj?lv) skulle st?llas inf?r r?tta f?r mordbrand. Den tredje dagen f?rdes Pierre med andra till ett hus d?r en fransk general med vit mustasch, tv? ?verstar och andra fransm?n med halsdukar p? h?nderna satt. Pierre, tillsammans med andra, st?lldes fr?gor om vem han var med den precision och s?kerhet som ?talade brukar behandlas med, vilket f?rmodligen ?verstiger m?nskliga svagheter. d?r han var? till vilken nytta? och s? vidare.
Dessa fr?gor, om man bortser fr?n essensen av livsfr?gan och utesluter m?jligheten att avsl?ja denna essens, liksom alla fr?gor som st?lls i domstolar, hade endast syftet att s?tta upp det sp?r l?ngs vilket domarna ville att svarandens svar skulle fl?da och leda honom till det ?nskade m?let, det vill s?ga till anklagelsen. S? fort han b?rjade s?ga n?got som inte tillfredsst?llde syftet med anklagelsen, tog de ett sp?r, och vattnet kunde rinna vart det ville. Dessutom upplevde Pierre samma sak som en tilltalad upplever i alla domstolar: f?rvirring ?ver varf?r alla dessa fr?gor st?lldes till honom. Han ans?g att det h?r tricket att s?tta in ett sp?r endast anv?ndes av nedl?tenhet eller, s? att s?ga, av artighet. Han visste att han var i dessa m?nniskors makt, att endast makt hade f?rt honom hit, att endast makt gav dem r?tt att kr?va svar p? fr?gor, att det enda syftet med detta m?te var att anklaga honom. Och d?rf?r, eftersom det fanns makt och det fanns en lust att anklaga, beh?vdes det inget knep med fr?gor och r?tteg?ng. Det var uppenbart att alla svar m?ste leda till skuld. P? fr?gan vad han gjorde n?r de tog honom, svarade Pierre med en tragedi att han bar ett barn till sina f?r?ldrar, qu"il avait sauve des flammes [som han r?ddade fr?n l?gorna]. - Varf?r slogs han med marod?ren Pierre svarade, att han f?rsvarade en kvinna, att det ?r varje m?nniskas plikt att skydda en f?rol?mpad kvinna, att... Han stoppades: detta gick inte till saken. Varf?r stod han p? g?rden till ett hus i brand , var vittnen s?g honom? Han svarade att han skulle se vad som h?nde i Moskva. De stoppade honom igen: de fr?gade honom inte vart han skulle, och varf?r var han n?ra elden? Vem var han? De upprepade den f?rsta fr?gan till honom, som han sa att han inte ville svara p?. ?terigen svarade han att han inte kunde s?ga att .
Som en exakt kvantitativ vetenskap kan fysiken inte klara sig utan en upps?ttning mycket viktiga konstanter som ing?r som universella koefficienter i ekvationer som etablerar samband mellan vissa storheter. Dessa ?r grundl?ggande konstanter, tack vare vilka s?dana relationer blir of?r?nderliga och kan f?rklara beteendet hos fysiska system i olika skalor.
Bland s?dana parametrar som k?nnetecknar de inneboende egenskaperna i v?rt universum finns Boltzmann-konstanten, en kvantitet som ing?r i ett antal av de viktigaste ekvationerna. Men innan man ?verv?ger dess egenskaper och betydelse kan man inte l?ta bli att s?ga n?gra ord om vetenskapsmannen vars namn den b?r.
Ludwig Boltzmann: vetenskapliga landvinningar
En av 1800-talets st?rsta vetenskapsm?n, ?sterrikaren Ludwig Boltzmann (1844-1906) gjorde ett betydande bidrag till utvecklingen av molekyl?r kinetisk teori och blev en av skaparna av statistisk mekanik. Han var f?rfattaren till den ergodiska hypotesen, en statistisk metod i beskrivningen av en idealgas, och den grundl?ggande ekvationen f?r fysisk kinetik. Han arbetade mycket med fr?gor om termodynamik (Boltzmanns H-sats, statistisk princip f?r termodynamikens andra lag), str?lningsteori (Stefan-Boltzmanns lag). I sina verk ber?rde han ocks? n?gra fr?gor om elektrodynamik, optik och andra grenar av fysiken. Hans namn ?r f?revigat i tv? fysiska konstanter, som kommer att diskuteras nedan.
Ludwig Boltzmann var en ?vertygad och konsekvent anh?ngare av teorin om materiens atom-molekyl?ra struktur. Under m?nga ?r fick han k?mpa med missf?rst?nd och f?rkastande av dessa id?er i den tidens vetenskapssamfund, d? m?nga fysiker ans?g atomer och molekyler vara en on?dig abstraktion, i b?sta fall en konventionell anordning f?r att underl?tta ber?kningar. En sm?rtsam sjukdom och attacker fr?n konservativa kollegor provocerade Boltzmann till en sv?r depression, som, of?rm?gen att b?ra, ledde till att den enast?ende vetenskapsmannen begick sj?lvmord. P? gravmonumentet, ovanf?r bysten av Boltzmann, som ett tecken p? erk?nnande av hans f?rtj?nster, ?r ekvationen S = k?logW ingraverad - ett av resultaten av hans fruktbara vetenskapliga arbete. Konstanten k i denna ekvation ?r Boltzmanns konstant.
Molekylernas energi och materiens temperatur
Begreppet temperatur tj?nar till att karakterisera graden av uppv?rmning av en viss kropp. Inom fysiken anv?nds en absolut temperaturskala, som ?r baserad p? slutsatsen av den molekyl?ra kinetiska teorin om temperatur som ett m?tt som ?terspeglar m?ngden energi av termisk r?relse av partiklar av ett ?mne (vilket naturligtvis betyder den genomsnittliga kinetiska energin f?r en upps?ttning partiklar).
B?de SI joule och erg som anv?nds i CGS-systemet ?r f?r stora enheter f?r att uttrycka molekylers energi, och i praktiken var det mycket sv?rt att m?ta temperatur p? detta s?tt. En l?mplig enhet f?r temperatur ?r graden, och m?tningen utf?rs indirekt, genom att registrera de f?r?ndrade makroskopiska egenskaperna hos ett ?mne - till exempel volym.

Hur h?nger energi och temperatur ihop?
F?r att ber?kna tillst?nden f?r verklig materia vid temperaturer och tryck n?ra normala anv?nds framg?ngsrikt modellen f?r en idealgas, det vill s?ga en vars molekylstorlek ?r mycket mindre ?n volymen som upptas av en viss m?ngd gas, och avst?ndet mellan partiklar ?verskrider avsev?rt radien f?r deras interaktion. Baserat p? kinetisk teoris ekvationer best?ms medelenergin f?r s?dana partiklar som E av = 3/2?kT, d?r E ?r den kinetiska energin, T ?r temperaturen och 3/2?k ?r proportionalitetskoefficienten som introduceras av Boltzmann. Siffran 3 h?r k?nnetecknar antalet frihetsgrader f?r translationell r?relse hos molekyler i tre rumsliga dimensioner.
V?rdet k, som senare fick namnet Boltzmann-konstanten f?r att hedra den ?sterrikiska fysikern, visar hur mycket av en joule eller erg som inneh?ller en grad. Med andra ord best?mmer dess v?rde hur mycket energin av termisk kaotisk r?relse hos en partikel av en monoatomisk idealgas ?kar statistiskt, i genomsnitt, med en ?kning av temperaturen med 1 grad.

Hur m?nga g?nger ?r en grad mindre ?n en joule?
Det numeriska v?rdet av denna konstant kan erh?llas p? olika s?tt, till exempel genom att m?ta absolut temperatur och tryck, anv?nda den ideala gasekvationen eller anv?nda en Brownsk r?relsemodell. Teoretisk h?rledning av detta v?rde p? nuvarande kunskapsniv? ?r inte m?jlig.
Boltzmanns konstant ?r lika med 1,38 x 10 -23 J/K (h?r ?r K kelvin, en grad p? den absoluta temperaturskalan). F?r en grupp partiklar i 1 mol av en idealgas (22,4 liter) erh?lls koefficienten f?r energi till temperatur (universell gaskonstant) genom att multiplicera Boltzmanns konstant med Avogadros tal (antal molekyler i en mol): R = kN A och ?r 8,31 J/(mol?kelvin). Men till skillnad fr?n den senare ?r Boltzmann-konstanten mer universell till sin natur, eftersom den ing?r i andra viktiga relationer och ?ven tj?nar till att best?mma en annan fysisk konstant.
Statistisk f?rdelning av molekyl?ra energier
Eftersom makroskopiska tillst?nd av materia ?r resultatet av beteendet hos en stor samling partiklar, beskrivs de med statistiska metoder. Det senare inkluderar ocks? att ta reda p? hur energiparametrarna f?r gasmolekyler ?r f?rdelade:
- Maxwellsk f?rdelning av kinetiska energier (och hastigheter). Den visar att i en gas i j?mviktstillst?nd har de flesta molekyler hastigheter n?ra n?gon mest trolig hastighet v = ?(2kT/m 0), d?r m 0 ?r molekylens massa.
- Boltzmann distribution av potentiella energier f?r gaser som finns i f?ltet av alla krafter, till exempel jordens gravitation. Det beror p? f?rh?llandet mellan tv? faktorer: attraktion till jorden och den kaotiska termiska r?relsen av gaspartiklar. Som ett resultat, ju l?gre potentiell energi f?r molekyler (n?rmare planetens yta), desto h?gre ?r deras koncentration.

B?da statistiska metoderna kombineras till en Maxwell-Boltzmann-f?rdelning som inneh?ller en exponentiell faktor e - E/kT, d?r E ?r summan av kinetiska och potentiella energier, och kT ?r den redan k?nda medelenergin f?r termisk r?relse, styrd av Boltzmann-konstanten.
Konstant k och entropi
I en allm?n mening kan entropi karakteriseras som ett m?tt p? irreversibiliteten hos en termodynamisk process. Denna irreversibilitet ?r f?rknippad med f?rsvinnandet - f?rsvinnandet - av energi. I det statistiska tillv?gag?ngss?ttet som Boltzmann f?reslagit ?r entropi en funktion av antalet s?tt p? vilka ett fysiskt system kan realiseras utan att ?ndra dess tillst?nd: S = k?lnW.
H?r specificerar konstanten k skalan f?r entropitillv?xt med en ?kning av detta antal (W) systemimplementeringsalternativ, eller mikrotillst?nd. Max Planck, som f?rde denna formel till sin moderna form, f?reslog att konstanten k skulle ge namnet Boltzmann.

Stefan-Boltzmann str?lningslag
Den fysiska lagen som fastst?ller hur den energetiska ljusstyrkan (str?lningseffekten per ytenhet) hos en absolut svart kropp beror p? dess temperatur har formen j = sT 4, det vill s?ga kroppen s?nder ut proportionellt mot den fj?rde potensen av sin temperatur. Denna lag anv?nds till exempel inom astrofysik, eftersom str?lningen fr?n stj?rnor ?r n?ra svartkroppsstr?lning i egenskaper.
I detta f?rh?llande finns en annan konstant, som ocks? styr fenomenets skala. Detta ?r Stefan-Boltzmann-konstanten s, som ?r ungef?r 5,67 x 10 -8 W/(m 2 ?K 4). Dess dimension inkluderar kelviner - vilket betyder att det ?r tydligt att Boltzmann-konstanten k ?r inblandad h?r ocks?. Faktum ?r att v?rdet p? s definieras som (2p 2 ?k 4)/(15c 2 h 3), d?r c ?r ljusets hastighet och h ?r Plancks konstant. S? Boltzmann-konstanten, i kombination med andra v?rldskonstanter, bildar en storhet som ?terigen kopplar samman energi (kraft) och temperatur - i detta fall i f?rh?llande till str?lning.

Den fysiska essensen av Boltzmann-konstanten
Det noterades redan ovan att Boltzmanns konstant ?r en av de s? kallade fundamentala konstanterna. Po?ngen ?r inte bara att den till?ter oss att uppr?tta ett samband mellan egenskaperna hos mikroskopiska fenomen p? molekyl?r niv? och parametrarna f?r processer som observeras i makrokosmos. Och inte bara att denna konstant ing?r i ett antal viktiga ekvationer.
Det ?r f?r n?rvarande ok?nt om det finns n?gon fysikalisk princip p? grundval av vilken den skulle kunna h?rledas teoretiskt. Det f?ljer med andra ord inte av n?gonting att v?rdet p? en given konstant ska vara exakt det. Vi skulle kunna anv?nda andra kvantiteter och andra enheter ist?llet f?r grader som ett m?tt p? ?verensst?mmelse med partiklarnas kinetiska energi, d? skulle det numeriska v?rdet av konstanten vara annorlunda, men det skulle f?rbli ett konstant v?rde. Tillsammans med andra fundamentala storheter av detta slag - den begr?nsande hastigheten c, Planck-konstanten h, element?rladdningen e, gravitationskonstanten G - accepterar vetenskapen Boltzmann-konstanten som en given av v?r v?rld och anv?nder den f?r en teoretisk beskrivning av den fysiska processer som sker i den.
(k eller k B)?r en fysisk konstant som definierar f?rh?llandet mellan temperatur och energi. Uppkallad efter den ?sterrikiske fysikern Ludwig Boltzmann, som gjorde stora bidrag till statistisk fysik, d?r detta blev en nyckelposition. Dess experimentella v?rde i SI-systemet ?rSiffrorna inom parentes anger standardfelet i de sista siffrorna i kvantitetsv?rdet. I princip kan Boltzmanns konstant erh?llas fr?n definitionen av absolut temperatur och andra fysikaliska konstanter (f?r att g?ra detta m?ste du kunna ber?kna temperaturen p? vattnets trippelpunkt utifr?n de f?rsta principerna). Men att best?mma Boltzmann-konstanten med hj?lp av de f?rsta principerna ?r f?r komplext och orealistiskt med den nuvarande kunskapsutvecklingen inom detta omr?de.
Boltzmanns konstant ?r en redundant fysisk konstant om man m?ter temperatur i energienheter, vilket v?ldigt ofta g?rs inom fysiken. Det ?r i sj?lva verket ett samband mellan en v?ldefinierad storhet - energi och grad, vars betydelse har utvecklats historiskt.
Definition av entropi
Entropin f?r ett termodynamiskt system definieras som den naturliga logaritmen av antalet olika mikrotillst?nd Z som motsvarar ett givet makroskopiskt tillst?nd (till exempel tillst?nd med en given total energi).
Proportionalitetsfaktor k och ?r Boltzmanns konstant. Detta uttryck, som definierar f?rh?llandet mellan mikroskopiska (Z) och makroskopiska (S) egenskaper, uttrycker den huvudsakliga (centrala) id?n om statistisk mekanik.
Bland de fundamentala konstanterna, Boltzmanns konstant k intar en speciell plats. Redan 1899 f?reslog M. Planck f?ljande fyra numeriska konstanter som grundl?ggande f?r konstruktionen av en enhetlig fysik: ljusets hastighet c, kvantum av handling h, gravitationskonstant G och Boltzmann konstant k. Bland dessa konstanter intar k en speciell plats. Den definierar inte element?ra fysikaliska processer och ing?r inte i dynamikens grundl?ggande principer, men den etablerar en koppling mellan mikroskopiska dynamiska fenomen och makroskopiska egenskaper hos partiklarnas tillst?nd. Det ing?r ocks? i den grundl?ggande naturlagen som relaterar systemets entropi S med den termodynamiska sannolikheten f?r dess tillst?nd W:
S=klnW (Boltzmann-formel)
och best?mma riktningen f?r fysiska processer i naturen. S?rskild uppm?rksamhet b?r ?gnas ?t det faktum att Boltzmann-konstantens upptr?dande i en eller annan formel f?r klassisk fysik varje g?ng tydligt indikerar den statistiska karakt?ren hos det fenomen som den beskriver. Att f?rst? den fysiska essensen av Boltzmanns konstant kr?ver att man avsl?jar enorma lager av fysik - statistik och termodynamik, evolutionsteorin och kosmogonin.
Forskning av L. Boltzmann
Sedan 1866 har den ?sterrikiske teoretikern L. Boltzmanns verk publicerats efter varandra. I dem f?r den statistiska teorin en s? solid grund att den f?rvandlas till en genuin vetenskap om de fysiska egenskaperna hos grupper av partiklar.
F?rdelningen erh?lls av Maxwell f?r det enklaste fallet av en monoatomisk idealgas. 1868 visade Boltzmann att polyatom?ra gaser i j?mviktstillst?nd ocks? kommer att beskrivas av Maxwell-f?rdelningen.
Boltzmann utvecklar i Clausius verk tanken att gasmolekyler inte kan betraktas som separata materiella punkter. Polyatomiska molekyler har ocks? rotation av molekylen som helhet och vibrationer av dess ing?ende atomer. Han introducerar antalet frihetsgrader f?r molekyler som antalet "variabler som kr?vs f?r att best?mma positionen f?r alla best?ndsdelar av en molekyl i rymden och deras position i f?rh?llande till varandra" och visar att fr?n experimentella data om v?rmekapaciteten hos gaser f?ljer att det finns en enhetlig f?rdelning av energi mellan de olika frihetsgraderna. Varje frihetsgrad st?r f?r samma energi
Boltzmann kopplade direkt mikrov?rldens egenskaper med makrov?rldens egenskaper. H?r ?r nyckelformeln som etablerar detta f?rh?llande:
1/2 mv2 = kT
Var m Och v- gasmolekylernas massa respektive medelhastighet, T- gastemperatur (p? den absoluta Kelvin-skalan), och k- Boltzmann konstant. Denna ekvation ?verbryggar gapet mellan de tv? v?rldarna och kopplar atomniv?egenskaper (p? v?nster sida) med bulkegenskaper (p? h?ger sida) som kan m?tas med hj?lp av m?nskliga instrument, i detta fall termometrar. Detta f?rh?llande tillhandah?lls av Boltzmanns konstant k, lika med 1,38 x 10-23 J/K.
N?r jag avslutar samtalet om Boltzmann-konstanten vill jag ?n en g?ng betona dess grundl?ggande betydelse inom vetenskapen. Den inneh?ller enorma lager av fysik - atomism och den molekyl?r-kinetiska teorin om materiens struktur, statistisk teori och k?rnan i termiska processer. Studiet av termiska processers irreversibilitet avsl?jade naturen av fysisk evolution, koncentrerad i Boltzmann-formeln S=klnW. Det b?r betonas att positionen enligt vilken ett slutet system f?rr eller senare kommer att n? ett tillst?nd av termodynamisk j?mvikt endast g?ller f?r isolerade system och system under station?ra yttre f?rh?llanden. Processer sker kontinuerligt i v?rt universum, resultatet av dessa ?r en f?r?ndring av dess rumsliga egenskaper. Universums icke-stationaritet leder oundvikligen till fr?nvaron av statistisk j?mvikt i det.
Enligt Stefan-Boltzmann-lagen, t?theten av integral hemisf?risk str?lning E 0 beror endast p? temperaturen och varierar proportionellt mot fj?rde potensen av absolut temperatur T:
Stefan–Boltzmann-konstanten s 0 ?r en fysikalisk konstant som ing?r i lagen som best?mmer den volymetriska densiteten f?r den termiska j?mviktsstr?lningen fr?n en absolut svart kropp:
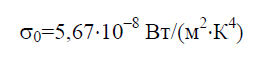
Historiskt sett formulerades Stefan-Boltzmann-lagen f?re Plancks str?lningslag, varav den f?ljer som en konsekvens. Plancks lag fastst?ller beroendet av str?lningens spektrala fl?dest?thet E 0 p? v?gl?ngd l och temperatur T:

d?r l – v?gl?ngd, m; Med=2,998 10 8 m/s – ljusets hastighet i vakuum; T– kroppstemperatur, K;
h= 6.625 x10 -34 Jxs – Plancks konstant.
Fysisk konstant k, lika med f?rh?llandet mellan den universella gaskonstanten R=8314J/(kgxK) till Avogadros nummer N.A.=6,022x10261/(kgxmol):

Antal olika systemkonfigurationer fr?n N partiklar f?r en given upps?ttning tal n i(antal partiklar i i-tillst?ndet som energin e i motsvarar) ?r proportionellt mot v?rdet:

Magnitud W det finns ett antal s?tt att distribuera N partiklar efter energiniv?er. Om relation (6) ?r sann, anses det ursprungliga systemet lyda Boltzmanns statistik. Upps?ttning siffror n i, d?r numret W maximum, f?rekommer oftast och motsvarar den mest sannolika f?rdelningen.
Fysisk kinetik– mikroskopisk teori om processer i statistiskt icke-j?mviktssystem.
Beskrivningen av ett stort antal partiklar kan framg?ngsrikt utf?ras med probabilistiska metoder. F?r en monoatomisk gas best?ms tillst?ndet f?r en upps?ttning molekyler av deras koordinater och v?rdena f?r hastighetsprojektioner p? motsvarande koordinataxlar. Matematiskt beskrivs detta av f?rdelningsfunktionen, som k?nnetecknar sannolikheten f?r att en partikel ?r i ett givet tillst?nd:

?r det f?rv?ntade antalet molekyler i en volym d d vars koordinater ligger i intervallet fr?n till +d, och vars hastigheter ligger i intervallet fr?n till +d.
Om den tidsgenomsnittliga potentiella energin f?r interaktion mellan molekyler kan f?rsummas i j?mf?relse med deras kinetiska energi, s? kallas gasen ideal. En idealgas kallas en Boltzmann-gas om f?rh?llandet mellan den fria v?gen f?r molekyler i denna gas och den karakteristiska storleken p? fl?det L naturligtvis, d.v.s.

d?rf?r att banl?ngden ?r omv?nt proportionell nd 2(n ?r den numeriska densiteten 1/m 3, d ?r molekylens diameter, m).
Storlek
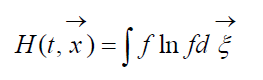
kallad H-Boltzmann-funktion f?r en volymenhet, som ?r associerad med sannolikheten att detektera ett system av gasmolekyler i ett givet tillst?nd. Varje tillst?nd motsvarar ett visst antal fyllande sexdimensionella rymdhastighetsceller i vilka fasutrymmet f?r de aktuella molekylerna kan delas in. L?t oss beteckna W sannolikheten att det kommer att finnas N 1 molekyler i den f?rsta cellen i det aktuella utrymmet, N 2 i den andra, etc.
Upp till en konstant som best?mmer ursprunget f?r sannolikheten ?r f?ljande relation giltig:
 ,
,
Var  – H-funktion f?r ett omr?de i rymden A upptagen av gas. Av (9) framg?r att W Och H sammankopplade, dvs. en f?r?ndring av sannolikheten f?r ett tillst?nd leder till en motsvarande utveckling av H-funktionen.
– H-funktion f?r ett omr?de i rymden A upptagen av gas. Av (9) framg?r att W Och H sammankopplade, dvs. en f?r?ndring av sannolikheten f?r ett tillst?nd leder till en motsvarande utveckling av H-funktionen.

Boltzmanns princip etablerar sambandet mellan entropi S fysiskt system och termodynamisk sannolikhet W hennes s?ger:

(publicerad enligt publikationen: Kogan M.N. Dynamics of a rarefied gas. - M.: Nauka, 1967.)
Allm?n bild av KUBEN:

var ?r masskraften p? grund av n?rvaron av olika f?lt (gravitationsf?lt, elektriska, magnetiska) som verkar p? molekylen; J– kollisionsintegral. Det ?r denna term i Boltzmann-ekvationen som tar h?nsyn till kollisioner av molekyler med varandra och motsvarande f?r?ndringar i hastigheterna hos interagerande partiklar. Kollisionsintegralen ?r en femdimensionell integral och har f?ljande struktur:

Ekvation (12) med integral (13) erh?lls f?r kollisioner av molekyler d?r inga tangentiella krafter uppst?r, d.v.s. kolliderande partiklar anses vara helt j?mna.
Under interaktionen f?r?ndras inte molekylernas inre energi, d.v.s. dessa molekyler antas vara perfekt elastiska. Vi betraktar tv? grupper av molekyler som har hastigheter och innan de kolliderar med varandra (kollision) (Fig. 1), respektive efter kollisionen hastigheter och . Skillnaden i hastighet kallas relativ hastighet, d.v.s. . Det ?r tydligt att f?r en smidig elastisk kollision. Distributionsfunktioner f 1 ", f", f 1 , f beskriva molekylerna f?r motsvarande grupper efter och f?re kollisioner, d.v.s. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Ris. 1. Kollision av tv? molekyler.
(13) inkluderar tv? parametrar som k?nnetecknar platsen f?r kolliderande molekyler i f?rh?llande till varandra: b och e; b– siktavst?nd, d.v.s. det minsta avst?ndet som molekyler skulle n?rma sig i fr?nvaro av interaktion (Fig. 2); e kallas kollisionsvinkelparametern (fig. 3). Integration ?ver b fr?n 0 till ? och fr?n 0 till 2p (tv? externa integraler i (12)) t?cker hela kraftplanet vinkelr?tt mot vektorn

Ris. 2. Molekylernas bana.

Ris. 3. ?verv?gande av interaktionen mellan molekyler i ett cylindriskt koordinatsystem: z, b, e
Boltzmanns kinetiska ekvation h?rleds under f?ljande antaganden och antaganden.
1. Man tror att fr?mst kollisioner av tv? molekyler f?rekommer, d.v.s. rollen av kollisioner av tre eller flera molekyler samtidigt ?r obetydlig. Detta antagande till?ter oss att anv?nda en enpartikelf?rdelningsfunktion f?r analys, som ovan helt enkelt kallas f?r distributionsfunktionen. Att ta h?nsyn till kollisionen mellan tre molekyler leder till behovet av att anv?nda en tv?partikelf?rdelningsfunktion i studien. F?ljaktligen blir analysen betydligt mer komplicerad.
2. Antagande om molekyl?rt kaos. Det uttrycks i det faktum att sannolikheterna f?r att detektera partikel 1 vid faspunkten och partikel 2 vid faspunkten ?r oberoende av varandra.
3. Kollisioner av molekyler med valfritt anslagsavst?nd ?r lika sannolika, d.v.s. f?rdelningsfunktionen ?ndras inte vid interaktionsdiametern. Det b?r noteras att det analyserade elementet m?ste vara litet s? att f inom detta element f?r?ndras inte, men samtidigt s? att den relativa fluktuationen ~ inte ?r stor. Interaktionspotentialerna som anv?nds vid ber?kning av kollisionsintegralen ?r sf?riskt symmetriska, dvs. ![]() .
.
Maxwell-Boltzmann distribution
Gasens j?mviktstillst?nd beskrivs av den absoluta Maxwellska f?rdelningen, som ?r en exakt l?sning av Boltzmanns kinetiska ekvation:

d?r m ?r molekylens massa, kg.
Den allm?nna lokala Maxwellian-distributionen, annars kallad Maxwell-Boltzmann-distributionen:

i fallet n?r gasen r?r sig som en helhet med hastigheten och variablerna n, T beror p? koordinaten
och tid t.
I jordens gravitationsf?lt visar den exakta l?sningen av Boltzmann-ekvationen:

Var n 0 = densitet vid jordens yta, 1/m3; g– gravitationsacceleration, m/s 2 ; h– h?jd, m. Formel (16) ?r en exakt l?sning av Boltzmanns kinetiska ekvation antingen i obegr?nsat utrymme eller i n?rvaro av gr?nser som inte bryter mot denna f?rdelning, samtidigt som temperaturen ocks? m?ste f?rbli konstant.
Den h?r sidan designades av Puzina Yu.Yu. med st?d av den ryska stiftelsen f?r grundforskning - projekt nr 08-08-00638.

 ladybe.ru
ladybe.ru





