Boltzmannova konstantna definicija. Boltzmannova konstanta
Boltzmannova konstanta ( ili ) - fizi?ka konstanta koja definira odnos izme?u temperature i energije. Ime je dobio po austrijskom fizi?aru Ludwigu Boltzmannu, koji je dao veliki doprinos statisti?koj fizici, u kojoj ova konstanta igra klju?nu ulogu. Njegova eksperimentalna vrijednost u Me?unarodnom sistemu jedinica (SI) je:
J/.
Brojevi u zagradama ozna?avaju standardnu gre?ku u posljednjim znamenkama vrijednosti koli?ine. U prirodnom sistemu Planckovih jedinica, prirodna jedinica temperature je data tako da je Boltzmanova konstanta jednaka jedinici.
Odnos izme?u temperature i energije
U homogenom idealnom gasu na apsolutnoj temperaturi , energija po svakom translacionom stepenu slobode je jednaka, kao ?to sledi iz Maksvelove raspodele, . Na sobnoj temperaturi (300°C) ova energija je J, ili 0,013 eV. U monoatomskom idealnom gasu, svaki atom ima tri stepena slobode koji odgovaraju tri prostorne ose, ?to zna?i da svaki atom ima energiju od .
Poznavaju?i toplotnu energiju, mo?emo izra?unati srednju kvadratnu brzinu atoma, koja je obrnuto proporcionalna kvadratnom korijenu atomske mase. Srednja kvadratna brzina na sobnoj temperaturi varira od 1370 m/s za helijum do 240 m/s za ksenon. U slu?aju molekularnog plina, situacija postaje slo?enija, na primjer, dvoatomski plin ima pet stupnjeva slobode (na niskim temperaturama, kada se ne pobu?uju vibracije atoma u molekuli).
Definicija entropije
Entropija termodinami?kog sistema je definisana kao prirodni logaritam broja razli?itih mikrostanja , koji odgovara datom makroskopskom stanju (na primjer, stanju sa datom ukupnom energijom).
Faktor proporcionalnosti i je Boltzmanova konstanta. Ovo je izraz koji definira odnos izme?u mikroskopskih ( ) i makroskopska stanja ( ), izra?ava sredi?nju ideju statisti?ke mehanike.
Fiksiranje pretpostavljene vrijednosti
XXIV Generalna konferencija o utezima i mjerama, odr?ana 17-21. oktobra 2011. godine, usvojila je rezoluciju u kojoj je, posebno, predlo?eno da se budu?a revizija Me?unarodnog sistema jedinica izvr?i na na?in da se fiksirati vrijednost Boltzmannove konstante, nakon ?ega ?e se smatrati odre?enom upravo. Kao rezultat toga, bit ?e izvr?eno ta?no jednakost k=1,380 6X 10 -23 J/K. Ova navodna fiksacija povezana je sa ?eljom da se redefinira jedinica termodinami?ke temperature kelvin, povezuju?i njenu vrijednost sa vrijedno??u Boltzmannove konstante.
vidi tako?e
Napi?ite recenziju o ?lanku "Boltzmannova konstanta"
Bilje?ke
| Ovo je nacrt ?lanka o termodinamici i statisti?koj fizici. Mo?ete pomo?i projektu dodavanjem. |
Odlomak koji karakteri?e Bolcmannovu konstantu
– Ali ?ta ovo zna?i? – rekla je Nata?a zami?ljeno.- Oh, ne znam koliko je sve ovo neobi?no! - rekla je Sonya, hvataju?i se za glavu.
Nekoliko minuta kasnije, knez Andrej je nazvao, a Nata?a je do?la da ga vidi; a Sonya, do?ivljavaju?i emociju i nje?nost koju je rijetko iskusila, ostala je na prozoru, razmi?ljaju?i o neobi?noj prirodi onoga ?to se dogodilo.
Na ovaj dan se pojavila prilika da se po?alju pisma vojsci, a grofica je napisala pismo svom sinu.
„Sonja“, rekla je grofica, podi?u?i glavu od pisma dok je njena ne?akinja prolazila pored nje. – Sonja, ne?e? li pisati Nikolenki? - re?e grofica tihim, drhtavim glasom, a u pogledu njenih umornih o?iju, gledaju?i kroz nao?are, Sonja je pro?itala sve ?to je grofica razumela u ovim re?ima. Ovaj pogled izra?avao je molbe, strah od odbijanja, stid ?to se mora tra?iti i spremnost na nepomirljivu mr?nju u slu?aju odbijanja.
Sonya pri?e grofici i, kle?e?i, poljubi joj ruku.
„Pisa?u, maman“, rekla je.
Sonya je bila smek?ana, uzbu?ena i dirnuta svime ?to se tog dana dogodilo, a posebno misterioznim izvo?enjem proricanja sudbine koje je upravo vidjela. Sada kada je znala da povodom obnove Nata?ine veze sa princem Andrejem, Nikolaj nije mogao da se o?eni princezom Marijom, radosno je osetila povratak onog raspolo?enja samopo?rtvovanja u kojem je volela i navikla da ?ivi. I sa suzama u o?ima i sa rado??u ?to je shvatila velikodu?no delo, ona je, nekoliko puta prekidana suzama koje su zamaglile njene bar?unaste crne o?i, napisala to dirljivo pismo ?ije je primanje toliko zadivilo Nikolaja.
U stra?arnici u koju je Pjer odveden, oficir i vojnici koji su ga odveli su se prema njemu odnosili neprijateljski, ali u isto vreme i s po?tovanjem. U njihovom odnosu prema njemu jo? se osje?ala sumnja ko je on (da li je vrlo va?na osoba), te neprijateljstvo zbog njihove jo? svje?e li?ne borbe s njim.
Ali kada je ujutro drugog dana do?la smjena, Pjer je osjetio da za novu gardu - za oficire i vojnike - to vi?e nema zna?enje koje je imalo za one koji su ga odveli. I zaista, u ovom velikom, debelom ?oveku u selja?kom kaftanu, stra?ari sutradan vi?e nisu videli onog ?ivog ?oveka koji se tako o?ajni?ki borio sa plja?ka?em i prate?im vojnicima i rekao sve?anu frazu o spasavanju deteta, ali je video samo sedamnaesti od onih koji su iz nekog razloga, po nalogu najvi?ih vlasti, zadr?ani, zarobljeni Rusi. Ako je bilo ne?to posebno u vezi sa Pjerom, to je bio samo njegov pla?ljiv, pa?ljivo zami?ljen izgled i francuski jezik, na kojem je, za Francuze iznena?uju?e, dobro govorio. Uprkos ?injenici da je Pjer istog dana bio povezan sa ostalim osumnji?enim, po?to je posebna prostorija koju je on zauzimao bila potrebna slu?beniku.
Svi Rusi koji su dr?ani uz Pjera bili su ljudi najni?eg ranga. I svi su ga, prepoznav?i Pjera kao majstora, klonili, pogotovo ?to je govorio francuski. Pjer je sa tugom ?uo ismevanje samog sebe.
Sljede?e ve?eri, Pjer je saznao da ?e se svim ovim zatvorenicima (a vjerovatno i njemu samom) suditi za podmetanje po?ara. Tre?eg dana, Pjer je sa drugima odveden u ku?u u kojoj su sedeli francuski general sa belim brkovima, dva pukovnika i drugi Francuzi sa ?alovima na rukama. Pjeru su, zajedno sa drugima, postavljana pitanja o tome ko je on sa precizno??u i sigurno??u s kojom se obi?no postupa prema optu?enima, navodno prevazilaze?i ljudske slabosti. gde je bio? u koju svrhu? i tako dalje.
Ova pitanja, ostavljaju?i po strani su?tinu ?ivotne stvari i isklju?uju?i mogu?nost otkrivanja te su?tine, kao i sva pitanja koja se postavljaju na sudovima, imala su za cilj samo da postave ?lijeb kojim su sudije htjele da okrivljeni odgovori teku i dovedu ga do ?eljeni cilj, odnosno optu?ba. ?im je po?eo da govori ne?to ?to nije odgovaralo svrsi optu?be, oni su uzeli brazdu, i voda je mogla da te?e gde je htela. Osim toga, Pjer je iskusio isto ?to i optu?eni do?ivljava na svim sudovima: zbunjenost za?to su mu postavljena sva ova pitanja. Smatrao je da se ovaj trik ubacivanja ?lijeba koristio samo iz snishodljivosti ili, takore?i, iz pristojnosti. Znao je da je on u vlasti tih ljudi, da ga je samo vlast dovela ovamo, da im je samo vlast dala pravo da tra?e odgovore na pitanja, da je jedini cilj ovog sastanka da ga optu?e. I stoga, po?to je postojala mo? i postojala je ?elja za optu?ivanjem, nije bilo potrebe za trikom pitanja i su?enja. Bilo je o?igledno da svi odgovori moraju dovesti do krivice. Na pitanje ?ta je radio kada su ga odveli, Pjer je s nekom tragedijom odgovorio da je nosio dete svojim roditeljima, qu"il avait sauve des flammes [koje je spasao od plamena]. - Za?to se borio sa plja?ka?em Pjer je odgovorio, da je branio ?enu, da je za?tita uvre?ene ?ene du?nost svakog ?oveka, da... Zaustavljen je: ovo nije i?lo u stvar. Za?to je on bio u dvori?tu ku?e u plamenu ,gde su ga videli svedoci?On je odgovorio da ide da vidi ?ta se de?ava u Moskvi.Opet su ga zaustavili:nisu ga pitali gde ide i za?to je blizu vatre?Ko je on?Ponavljali su prvo mu pitanje na koje je rekao da ne zeli da odgovori.Opet je odgovorio da to ne moze da kaze.
Kao egzaktna kvantitativna nauka, fizika ne mo?e bez skupa veoma va?nih konstanti koje su uklju?ene kao univerzalni koeficijenti u jedna?ine koje uspostavljaju odnose izme?u odre?enih veli?ina. To su fundamentalne konstante, zahvaljuju?i kojima takvi odnosi postaju invarijantni i mogu da objasne pona?anje fizi?kih sistema na razli?itim skalama.
Me?u takvim parametrima koji karakteri?u svojstva svojstvena materiji na?eg univerzuma je Boltzmannova konstanta, veli?ina uklju?ena u brojne najva?nije jedna?ine. Me?utim, prije nego ?to pre?emo na razmatranje njegovih karakteristika i zna?aja, ne mo?e se ne re?i nekoliko rije?i o nau?niku ?ije ime nosi.
Ludwig Boltzmann: nau?na dostignu?a
Jedan od najve?ih nau?nika 19. veka, Austrijanac Ludwig Boltzmann (1844-1906) dao je zna?ajan doprinos razvoju molekularne kineti?ke teorije, postav?i jedan od tvoraca statisti?ke mehanike. Autor je ergodi?ke hipoteze, statisti?ke metode u opisu idealnog gasa i osnovne jednad?be fizi?ke kinetike. Mnogo je radio na pitanjima termodinamike (Boltzmannova H-teorema, statisti?ki princip za drugi zakon termodinamike), teoriji zra?enja (Stefan-Boltzmannov zakon). U svojim radovima dotakao se i nekih pitanja elektrodinamike, optike i drugih grana fizike. Njegovo ime je ovjekovje?eno u dvije fizi?ke konstante, o kojima ?e biti rije?i u nastavku.
Ludwig Boltzmann je bio uvjeren i dosljedan pristalica teorije atomsko-molekularne strukture materije. Dugi niz godina morao se boriti s nerazumijevanjem i odbacivanjem ovih ideja u tada?njoj nau?noj zajednici, kada su mnogi fizi?ari atome i molekule smatrali nepotrebnom apstrakcijom, u najboljem slu?aju konvencionalnim ure?ajem za prakti?nost prora?una. Bolna bolest i napadi konzervativnih kolega isprovocirali su Boltzmanna u te?ku depresiju, koja je, nesposobna da podnese, navela izuzetnog nau?nika da izvr?i samoubistvo. Na nadgrobnom spomeniku, iznad Bolcmanove biste, u znak priznanja njegovih zasluga, uklesana je jedna?ina S = k?logW - jedan od rezultata njegovog plodnog nau?nog rada. Konstanta k u ovoj jedna?ini je Boltzmanova konstanta.
Energija molekula i temperatura materije
Koncept temperature slu?i za karakterizaciju stepena zagrevanja odre?enog tela. U fizici se koristi apsolutna temperaturna skala, koja se zasniva na zaklju?ku molekularno-kineti?ke teorije o temperaturi kao mjeri koja odra?ava koli?inu energije toplotnog kretanja ?estica tvari (podrazumijeva, naravno, prosje?nu kineti?ku energiju skup ?estica).
I SI d?ul i erg koji se koriste u CGS sistemu su prevelike jedinice da bi izrazile energiju molekula, a u praksi je bilo veoma te?ko izmeriti temperaturu na ovaj na?in. Prikladna jedinica za temperaturu je stepen, a mjerenje se vr?i indirektno, kroz snimanje promjenjivih makroskopskih karakteristika supstance - na primjer, zapremine.

Kako su energija i temperatura povezani?
Za izra?unavanje stanja stvarne materije na temperaturama i pritiscima bliskim normalnim, uspje?no se koristi model idealnog plina, odnosno onog ?ija je molekularna veli?ina mnogo manja od zapremine koju zauzima odre?ena koli?ina plina, a udaljenosti izme?u ?estica zna?ajno prema?uje radijus njihove interakcije. Na osnovu jednad?bi kineti?ke teorije, prosje?na energija takvih ?estica odre?ena je kao E av = 3/2?kT, gdje je E kineti?ka energija, T je temperatura, a 3/2?k je koeficijent proporcionalnosti uveden pomo?u Boltzmann. Broj 3 ovdje karakterizira broj stupnjeva slobode translacijskog kretanja molekula u tri prostorne dimenzije.
Vrijednost k, koja je kasnije nazvana Boltzmannom konstantom u ?ast austrijskog fizi?ara, pokazuje koliki dio d?ula ili erga sadr?i jedan stepen. Drugim rije?ima, njegova vrijednost odre?uje koliko se statisti?ki, u prosjeku, pove?ava energija termi?kog haoti?nog kretanja jedne ?estice jednoatomnog idealnog plina s porastom temperature za 1 stepen.

Koliko je puta stepen manji od d?ula?
Numeri?ka vrijednost ove konstante mo?e se dobiti na razli?ite na?ine, na primjer, mjerenjem apsolutne temperature i tlaka, kori?tenjem jedna?ine idealnog plina ili kori?tenjem Brownovog modela kretanja. Teorijsko izvo?enje ove vrijednosti na sada?njem nivou znanja nije mogu?e.
Boltzmanova konstanta je jednaka 1,38 x 10 -23 J/K (ovdje je K kelvin, stepen na apsolutnoj temperaturnoj skali). Za grupu ?estica u 1 molu idealnog plina (22,4 litre), koeficijent koji se odnosi na energiju i temperaturu (univerzalna plinska konstanta) se dobija mno?enjem Boltzmannove konstante s Avogadrovim brojem (brojem molekula u molu): R = kN A, i iznosi 8,31 J/(mol?kelvin). Me?utim, za razliku od potonjeg, Boltzmannova konstanta je univerzalnije prirode, jer je uklju?ena u druge va?ne odnose, a slu?i i za odre?ivanje druge fizi?ke konstante.
Statisti?ka distribucija molekularnih energija
Budu?i da su makroskopska stanja materije rezultat pona?anja velike kolekcije ?estica, ona su opisana statisti?kim metodama. Ovo posljednje tako?er uklju?uje otkrivanje kako su energetski parametri molekula plina raspore?eni:
- Maksvelova raspodela kineti?kih energija (i brzina). Pokazuje da u gasu u stanju ravnote?e, ve?ina molekula ima brzine bliske nekoj najvjerovatnijoj brzini v = ?(2kT/m 0), gdje je m 0 masa molekula.
- Boltzmannova raspodjela potencijalnih energija za plinove koji se nalaze u polju bilo koje sile, na primjer, Zemljine gravitacije. Zavisi od odnosa izme?u dva faktora: privla?nosti prema Zemlji i haoti?nog termi?kog kretanja ?estica plina. Kao rezultat toga, ?to je ni?a potencijalna energija molekula (bli?e povr?ini planete), to je njihova koncentracija ve?a.

Obje statisti?ke metode su kombinovane u Maxwell-Boltzmannovu distribuciju koja sadr?i eksponencijalni faktor e - E/ kT, gdje je E zbir kineti?ke i potencijalne energije, a kT je ve? poznata prosje?na energija toplotnog kretanja, kontrolirana Boltzmannom konstantom.
Konstanta k i entropija
U op?tem smislu, entropija se mo?e okarakterisati kao mera ireverzibilnosti termodinami?kog procesa. Ova ireverzibilnost je povezana sa disipacijom - disipacijom - energije. U statisti?kom pristupu koji je predlo?io Boltzmann, entropija je funkcija broja na?ina na koje se fizi?ki sistem mo?e realizovati bez promjene njegovog stanja: S = k?lnW.
Ovdje konstanta k specificira skalu rasta entropije sa pove?anjem ovog broja (W) opcija implementacije sistema, ili mikrostanja. Max Planck, koji je ovu formulu doveo do njenog modernog oblika, predlo?io je da se konstanti k da ime Boltzmann.

Stefan-Boltzmann zakon zra?enja
Zakon fizike koji utvr?uje kako energetska luminoznost (snaga zra?enja po jedinici povr?ine) apsolutno crnog tijela ovisi o njegovoj temperaturi ima oblik j = sT 4, odnosno tijelo emituje proporcionalno ?etvrtom stepenu svoje temperature. Ovaj zakon se koristi, na primjer, u astrofizici, jer je zra?enje zvijezda po karakteristikama blisko zra?enju crnog tijela.
U ovom odnosu postoji jo? jedna konstanta, koja tako?e kontroli?e razmere fenomena. Ovo je Stefan-Boltzmannova konstanta s, koja iznosi pribli?no 5,67 x 10 -8 W/(m 2 ?K 4). Njegova dimenzija uklju?uje kelvine - ?to zna?i da je jasno da je ovdje uklju?ena i Boltzmannova konstanta k. Zaista, vrijednost s je definirana kao (2p 2 ?k 4)/(15c 2 h 3), gdje je c brzina svjetlosti, a h Plankova konstanta. Dakle, Boltzmannova konstanta, u kombinaciji s drugim svjetskim konstantama, formira veli?inu koja opet povezuje energiju (snagu) i temperaturu - u ovom slu?aju u odnosu na zra?enje.

Fizi?ka su?tina Boltzmannove konstante
Ve? je gore navedeno da je Boltzmanova konstanta jedna od takozvanih fundamentalnih konstanti. Poenta nije samo u tome da nam omogu?ava da uspostavimo vezu izme?u karakteristika mikroskopskih pojava na molekularnom nivou i parametara procesa posmatranih u makrokosmosu. I ne samo da je ova konstanta uklju?ena u brojne va?ne jedna?ine.
Trenutno je nepoznato postoji li neki fizi?ki princip na osnovu kojeg bi se to teoretski moglo izvesti. Drugim rije?ima, ni iz ?ega ne proizlazi da vrijednost date konstante treba biti upravo tolika. Kao mjeru uskla?enosti s kineti?kom energijom ?estica mogli bismo koristiti druge veli?ine i druge jedinice umjesto stupnjeva, tada bi numeri?ka vrijednost konstante bila druga?ija, ali bi ostala konstantna vrijednost. Uz druge fundamentalne veli?ine ove vrste - grani?nu brzinu c, Planckovu konstantu h, elementarni naboj e, gravitacionu konstantu G - nauka prihvata Boltzmannu konstantu kao datost na?eg svijeta i koristi je za teorijski opis fizi?kog procesa koji se u njemu odvijaju.
(k ili k B) je fizi?ka konstanta koja definira odnos izme?u temperature i energije. Ime je dobio po austrijskom fizi?aru Ludwigu Boltzmannu, koji je dao veliki doprinos statisti?koj fizici, u kojoj je ovo postalo klju?no mjesto. Njegova eksperimentalna vrijednost u SI sistemu jeBrojevi u zagradama ozna?avaju standardnu gre?ku u posljednjim znamenkama vrijednosti koli?ine. U principu, Boltzmannova konstanta se mo?e dobiti iz definicije apsolutne temperature i drugih fizi?kih konstanti (da biste to u?inili, morate biti u stanju izra?unati temperaturu trostruke ta?ke vode iz prvih principa). Ali odre?ivanje Boltzmannove konstante kori?tenjem prvih principa je previ?e slo?eno i nerealno s trenutnim razvojem znanja u ovoj oblasti.
Boltzmannova konstanta je redundantna fizi?ka konstanta ako temperaturu mjerite u jedinicama energije, ?to se vrlo ?esto radi u fizici. To je, u stvari, veza izme?u dobro definisane veli?ine – energije i stepena, ?ije se zna?enje istorijski razvijalo.
Definicija entropije
Entropija termodinami?kog sistema je definisana kao prirodni logaritam broja razli?itih mikrostanja Z koja odgovaraju datom makroskopskom stanju (na primer, stanja sa datom ukupnom energijom).
Faktor proporcionalnosti k i je Boltzmanova konstanta. Ovaj izraz, koji definira odnos izme?u mikroskopskih (Z) i makroskopskih (S) karakteristika, izra?ava glavnu (centralnu) ideju statisti?ke mehanike.
Me?u fundamentalnim konstantama, Boltzmannova konstanta k zauzima posebno mesto. M. Planck je jo? 1899. godine predlo?io sljede?e ?etiri numeri?ke konstante kao osnovne za konstrukciju jedinstvene fizike: brzinu svjetlosti c, kvant akcije h, gravitaciona konstanta G i Boltzmannova konstanta k. Me?u ovim konstantama, k zauzima posebno mjesto. On ne defini?e elementarne fizi?ke procese i nije uklju?en u osnovne principe dinamike, ali uspostavlja vezu izme?u mikroskopskih dinami?kih pojava i makroskopskih karakteristika stanja ?estica. Tako?e je uklju?en u osnovni zakon prirode koji povezuje entropiju sistema S sa termodinami?kom vjerovatno?om njegovog stanja W:
S=klnW (Boltzmannova formula)
i odre?ivanje pravca fizi?kih procesa u prirodi. Posebnu pa?nju treba obratiti na ?injenicu da pojava Boltzmannove konstante u jednoj ili drugoj formuli klasi?ne fizike svaki put jasno ukazuje na statisti?ku prirodu fenomena koji opisuje. Razumijevanje fizi?ke su?tine Boltzmannove konstante zahtijeva otkrivanje ogromnih slojeva fizike – statistike i termodinamike, teorije evolucije i kosmogonije.
Istra?ivanje L. Boltzmanna
Od 1866. radovi austrijskog teoreti?ara L. Boltzmanna objavljuju se jedan za drugim. U njima statisti?ka teorija dobija tako ?vrstu osnovu da se pretvara u pravu nauku o fizi?kim svojstvima grupa ?estica.
Raspodjelu je dobio Maxwell za najjednostavniji slu?aj monoatomskog idealnog plina. Godine 1868. Boltzmann je pokazao da ?e poliatomski plinovi u stanju ravnote?e tako?er biti opisani Maxwellovom raspodjelom.
Boltzmann u Clausiusovim djelima razvija ideju da se molekule plina ne mogu smatrati zasebnim materijalnim ta?kama. Poliatomski molekuli tako?er imaju rotaciju molekula kao cjeline i vibracije njegovih sastavnih atoma. On uvodi broj stupnjeva slobode molekula kao broj „promjenjivih potrebnih za odre?ivanje polo?aja svih sastavnih dijelova molekula u prostoru i njihovog polo?aja jedan u odnosu na drugi“ i pokazuje da iz eksperimentalnih podataka o toplinskom kapacitetu gasova proizlazi da postoji ujedna?ena distribucija energije izme?u razli?itih stupnjeva slobode. Svaki stepen slobode predstavlja istu energiju
Boltzmann je direktno povezao karakteristike mikrosvijeta sa karakteristikama makrosvijeta. Evo klju?ne formule koja uspostavlja ovaj odnos:
1/2 mv2 = kT
Gdje m I v- masa i prosje?na brzina kretanja molekula plina, T- temperatura gasa (na apsolutnoj Kelvinovoj skali), i k- Boltzmannova konstanta. Ova jedna?ina premo??uje jaz izme?u dva svijeta, povezuju?i svojstva atomskog nivoa (na lijevoj strani) sa svojstvima mase (na desnoj strani) koja se mogu mjeriti pomo?u ljudskih instrumenata, u ovom slu?aju termometara. Ovaj odnos obezbe?uje Boltzmannova konstanta k, jednaka 1,38 x 10-23 J/K.
Zavr?avaju?i razgovor o Boltzmannovoj konstanti, ?elio bih jo? jednom naglasiti njen fundamentalni zna?aj u nauci. Sadr?i ogromne slojeve fizike - atomizam i molekularno-kineti?ku teoriju strukture materije, statisti?ku teoriju i su?tinu toplotnih procesa. Prou?avanje ireverzibilnosti termi?kih procesa otkrilo je prirodu fizi?ke evolucije, koncentriranu u Boltzmannovoj formuli S=klnW. Treba naglasiti da pozicija prema kojoj ?e zatvoreni sistem prije ili kasnije do?i u stanje termodinami?ke ravnote?e vrijedi samo za izolovane sisteme i sisteme u stacionarnim vanjskim uvjetima. U na?em univerzumu se kontinuirano odvijaju procesi ?iji je rezultat promjena njegovih prostornih svojstava. Nestacionarnost Univerzuma neizbe?no dovodi do odsustva statisti?ke ravnote?e u njemu.
Prema Stefan-Boltzmann zakonu, gustina integralnog hemisfernog zra?enja E 0 zavisi samo od temperature i varira proporcionalno ?etvrtom stepenu apsolutne temperature T:
Stefan-Boltzmannova konstanta s 0 je fizi?ka konstanta uklju?ena u zakon koji odre?uje zapreminsku gustinu ravnote?nog toplotnog zra?enja apsolutno crnog tijela:
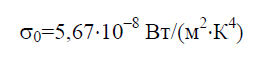
Istorijski gledano, Stefan-Boltzmann zakon je formulisan prije Planckovog zakona zra?enja, iz ?ega proizlazi kao posljedica. Plankov zakon utvr?uje zavisnost spektralne gustine fluksa zra?enja E 0 na talasnoj du?ini l i temperaturi T:

gdje je l – talasna du?ina, m; With=2.998 10 8 m/s – brzina svjetlosti u vakuumu; T– tjelesna temperatura, K;
h= 6,625 x10 -34 Jxs – Plankova konstanta.
Fizi?ka konstanta k, jednak omjeru univerzalne plinske konstante R=8314J/(kgxK) na Avogadrov broj N / A.=6,022x 10 26 1/(kgxmol):

Broj razli?itih konfiguracija sistema od N?estice za dati skup brojeva n i(broj ?estica u i-stanje kojem odgovara energija e i) proporcionalno je vrijednosti:

Magnituda W postoji vi?e na?ina distribucije N?estice po energetskim nivoima. Ako je relacija (6) ta?na, onda se smatra da se originalni sistem pridr?ava Boltzmannove statistike. Skup brojeva n i, na kojem je broj W maksimum, javlja se naj?e??e i odgovara najvjerovatnijoj distribuciji.
Fizi?ka kinetika– mikroskopska teorija procesa u statisti?ki neravnote?nim sistemima.
Opis velikog broja ?estica mo?e se uspje?no provesti kori?tenjem probabilisti?kih metoda. Za jednoatomni plin, stanje skupa molekula odre?eno je njihovim koordinatama i vrijednostima projekcija brzina na odgovaraju?e koordinatne osi. Matemati?ki, ovo je opisano funkcijom distribucije, koja karakterizira vjerovatno?u da ?e ?estica biti u datom stanju:

je o?ekivani broj molekula u zapremini d d ?ije su koordinate u rasponu od do +d, a ?ije su brzine u rasponu od do +d.
Ako se vremenski prosje?na potencijalna energija interakcije molekula mo?e zanemariti u usporedbi s njihovom kineti?kom energijom, tada se plin naziva idealnim. Idealan plin se naziva Boltzmannov plin ako je omjer du?ine putanje molekula u tom plinu i karakteristi?ne veli?ine protoka L naravno, tj.

jer du?ina putanje je obrnuto proporcionalna nd 2(n je numeri?ka gustina 1/m 3, d je pre?nik molekula, m).
Veli?ina
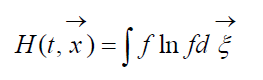
pozvao H-Boltzmannova funkcija za jedini?nu zapreminu, koja je povezana sa verovatno?om detekcije sistema molekula gasa u datom stanju. Svako stanje odgovara odre?enom broju popunjavanja ?estodimenzionalnih ?elija prostorne brzine na koje se mo?e podijeliti fazni prostor razmatranih molekula. Ozna?imo W vjerovatno?a da ?e u prvoj ?eliji prostora koji se razmatra biti N 1 molekula, u drugoj N 2 itd.
Do konstante koja odre?uje porijeklo vjerovatno?e vrijedi sljede?a relacija:
 ,
,
Gdje  – H-funkcija podru?ja prostora A okupirani gasom. Iz (9) je jasno da W I H me?usobno povezani, tj. promjena vjerovatno?e stanja dovodi do odgovaraju?e evolucije H funkcije.
– H-funkcija podru?ja prostora A okupirani gasom. Iz (9) je jasno da W I H me?usobno povezani, tj. promjena vjerovatno?e stanja dovodi do odgovaraju?e evolucije H funkcije.

Boltzmanov princip uspostavlja vezu izme?u entropije S fizi?ki sistem i termodinami?ka vjerovatno?a W njene navode:

(objavljeno prema publikaciji: Kogan M.N. Dinamika razrije?enog plina. - M.: Nauka, 1967.)
Op?ti pogled na CUBE:

gdje je sila mase zbog prisustva razli?itih polja (gravitacijskih, elektri?nih, magnetskih) koja djeluju na molekulu; J– integral sudara. Ovaj ?lan Boltzmannove jednad?be uzima u obzir sudare molekula me?usobno i odgovaraju?e promjene u brzinama ?estica koje djeluju. Integral sudara je petodimenzionalni integral i ima sljede?u strukturu:

Jedna?ina (12) sa integralom (13) dobijena je za sudare molekula u kojima ne nastaju tangencijalne sile, tj. ?estice koje se sudaraju smatraju se savr?eno glatkim.
Tokom interakcije unutra?nja energija molekula se ne mijenja, tj. Pretpostavlja se da su ovi molekuli savr?eno elasti?ni. Razmatramo dvije grupe molekula koje imaju brzine i prije me?usobnog sudara (sudar) (slika 1), a nakon sudara, respektivno, brzine i . Razlika u brzini naziva se relativna brzina, tj. . Jasno je da za glatki elasti?ni sudar . Funkcije distribucije f 1 ", f", f 1 , f opisuju molekule odgovaraju?ih grupa nakon i prije sudara, tj. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Rice. 1. Sudar dvaju molekula.
(13) uklju?uje dva parametra koji karakteriziraju lokaciju sudaraju?ih molekula u odnosu jedan prema drugom: b i e; b– ni?anska daljina, tj. najmanja udaljenost kojoj bi se molekuli pribli?ili u odsustvu interakcije (slika 2); e se naziva kolizioni ugaoni parametar (slika 3). Integracija je zavr?ena b od 0 do ? i od 0 do 2p (dva vanjska integrala u (12)) pokriva cijelu ravan interakcije sila okomitu na vektor

Rice. 2. Putanja molekula.

Rice. 3. Razmatranje interakcije molekula u cilindri?nom koordinatnom sistemu: z, b, e
Boltzmannova kineti?ka jedna?ina je izvedena pod sljede?im pretpostavkama i pretpostavkama.
1. Smatra se da uglavnom dolazi do sudara dvaju molekula, tj. uloga sudara tri ili vi?e molekula istovremeno je bezna?ajna. Ova pretpostavka nam omogu?ava da za analizu koristimo funkciju raspodjele jedne ?estice, koja se gore jednostavno naziva funkcija distribucije. Uzimanje u obzir sudara tri molekula dovodi do potrebe da se u istra?ivanju koristi funkcija raspodjele s dvije ?estice. Shodno tome, analiza postaje znatno komplikovanija.
2. Pretpostavka molekularnog haosa. Izra?ava se u ?injenici da su vjerovatno?e detekcije ?estice 1 u faznoj ta?ki i ?estice 2 u faznoj ta?ki nezavisne jedna od druge.
3. Jednako su vjerovatni sudari molekula na bilo kojoj udaljenosti udara, tj. funkcija distribucije se ne mijenja na pre?niku interakcije. Treba napomenuti da analizirani element mora biti mali tako da f unutar ovog elementa se ne mijenja, ali u isto vrijeme tako da relativna fluktuacija ~ nije velika. Interakcioni potencijali koji se koriste za izra?unavanje integrala sudara su sferno simetri?ni, tj. ![]() .
.
Maxwell-Boltzmannova distribucija
Stanje ravnote?e gasa opisuje se apsolutnom Maksvelovskom raspodelom, koja je ta?no re?enje Bolcmanove kineti?ke jedna?ine:

gdje je m masa molekula, kg.
Op?a lokalna Maxwellova distribucija, ina?e nazvana Maxwell-Boltzmannova distribucija:

u slu?aju kada se gas kre?e kao celina brzinom i varijable n, T zavise od koordinata
i vrijeme t.
U Zemljinom gravitacionom polju, ta?no re?enje Bolcmanove jedna?ine pokazuje:

Gdje n 0 = gustina na povr?ini Zemlje, 1/m3; g– ubrzanje gravitacije, m/s 2 ; h– visina, m. Formula (16) je ta?no rje?enje Boltzmannove kineti?ke jedna?ine bilo u neograni?enom prostoru ili u prisustvu granica koje ne naru?avaju ovu raspodjelu, a temperatura tako?er mora ostati konstantna.
Ovu stranicu je dizajnirao Puzina Yu.Yu. uz podr?ku Ruske fondacije za osnovna istra?ivanja - projekat br. 08-08-00638.

 ladybe.ru
ladybe.ru





